HemaBook, Capitolo 7: Qual è la correlazione tra D-dimero nella coagulazione e COVID-19?
Mindray 2021-01-26

D-dimero nel COVID-19
Con l'aumento costante dei casi di COVD-19 in tutto il mondo, è essenziale fornire diagnosi, prognosi e trattamento rapidi dei pazienti. Di recente gli scienziati hanno scoperto che il COVID-19 presenta un recettore della cellula ospite, l'enzima di conversione dell'angiotensina II[1] o ACE2. Con l'aiuto di ACE2, COVID-19 invade rapidamente il corpo umano riproducendosi da solo a una velocità elevata, distruggendo cellule, tessuti e il sistema microvascolare, causando infine lesioni polmonari acute, sindrome da disfunzione multiorgano[2-4] e coagulazione intravascolare che si verifica nel 71,4% dei pazienti deceduti a causa del COVID-19[5]. È ampiamente noto che il D-dimero è un biomarcatore significativo correlato all'ipercoagulabilità. Altri studi clinici hanno anche individuato la relazione tra D-dimero e COVID-19.
Come pubblicato su Jama dal gruppo di Zhi Yong, nel gruppo di pazienti deceduti (non sopravvissuti) con polmonite da nuovo coronavirus, durante il decorso della malattia il livello di D-dimero aumentava fino al settimo giorno, per poi superare il range normale e stabilizzarsi su un livello elevato [Figura 1 A][6]. Il gruppo di sopravvissuti invece rimaneva costantemente nel range normale. Un articolo pubblicato sul Lancet evidenzia una stretta correlazione tra il livello di D-dimero e il tasso di mortalità [Figura 1 B][7]. È stata raggiunta la stessa conclusione anche in uno studio di Shah, in cui veniva utilizzato un metodo di meta-analisi sistematica (includendo risultati di 18 articoli e un totale di 3.682 pazienti) per stilare il forest plot [Figura 1 C, D][8]. Nei casi più gravi di COVID-19 o nei pazienti deceduti il livello di D-dimero era più elevato di quello dei pazienti non gravi o sopravvissuti.
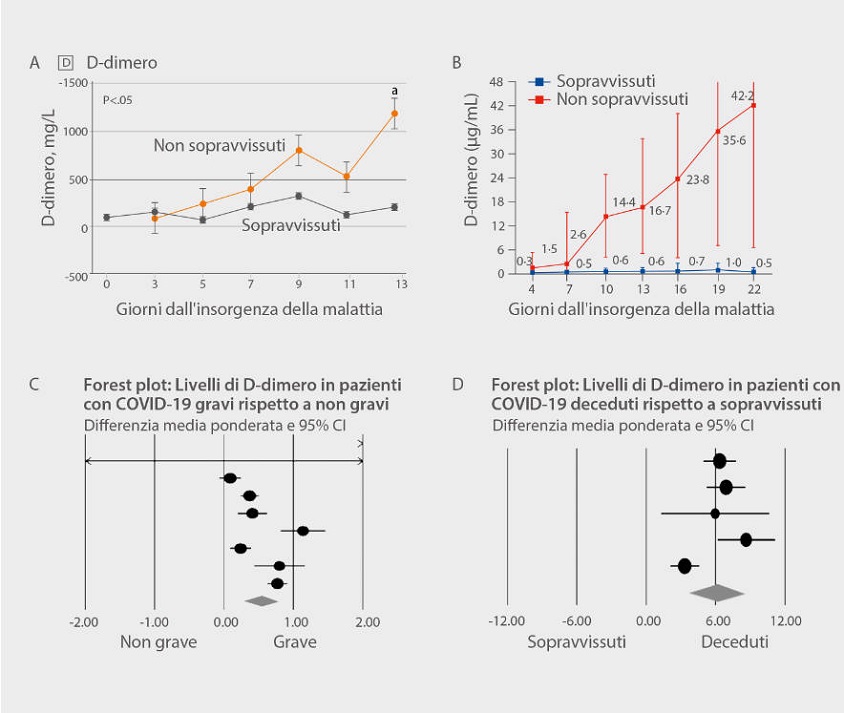
D-dimero e prognosi dei casi con COVID-19
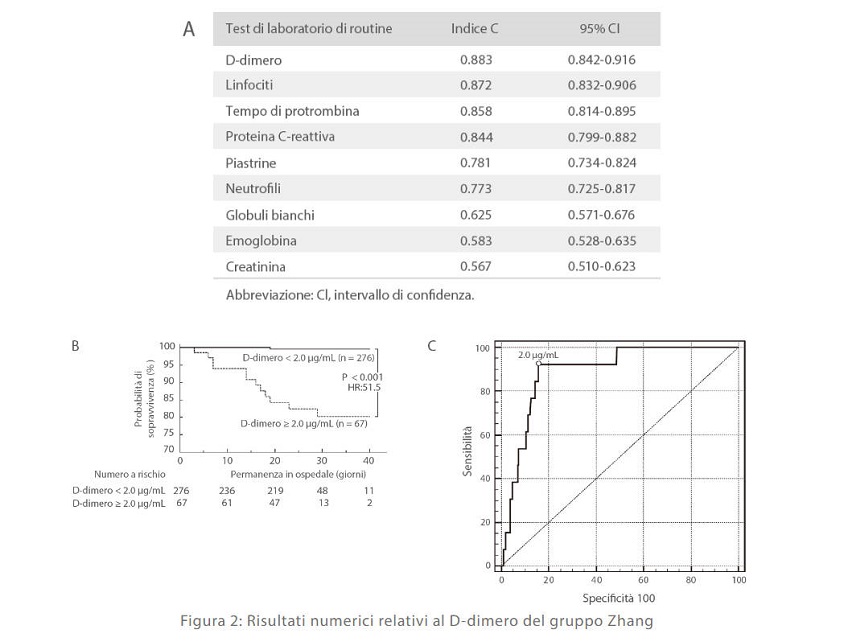
Secondo lo studio del gruppo di Zhang, tra tutti i parametri testati nei pazienti con COVID-19 il D-dimero presentava il più alto C-index, che indica il tasso di coincidenza della previsione più elevato nei metodi di analisi di laboratorio di routine [Figura 3 A]. Inoltre, hanno anche notato che il valore pari a 2 μg/ml di D-dimero potrebbe costituire la soglia del rischio di mortalità da COVID-19: con DD > 2 μg/ml la probabilità di sopravvivenza diminuisce drasticamente [Figura 2 B]. Di conseguenza, hanno basato la valutazione di questo valore e hanno rilevato che l'impostazione di un valore soglia di 2 μg/ml, una sensibilità del 92,3% e una specificità dell'83,3% è ottimale per tutti i gruppi [Figura 2 C][9].
È stato evidenziato un aumento dell'incidenza di eventi tromboembolici venosi (VTE), tra cui trombosi venosa profonda (DVT) ed embolia polmonare (PE), in pazienti con infezione grave da COVID-19[9], Il D-dimero può essere utilizzato anche come indicatore di monitoraggio di VTE e PE con un valore di soglia di 0,55 μg/ml. Inoltre, Yao non solo ha constatato che i pazienti con un valore di D-dimero superiore a 2 μg/ml necessitavano di cure intensive e di un intervento precoce, ma ha suggerito l'impostazione di un valore di soglia di 1 μg/ml per consentire ai medici di identificare i pazienti con una prognosi sfavorevole[10].
In conclusione, il D-dimero ha un grande valore clinico come indice di monitoraggio sensibile nel trattamento e nella prognosi di COVID-19. Considerando il microambiente di coagulazione disordinato nei pazienti infettati da COVID-19 o ad alto rischio di VTE indotti da una ridotta attività, da un maggiore tempo a letto o nelle persone in quarantena per il ricovero ospedaliero, si rivela necessario verificare i valori di D-dimero su base regolare per un rapido monitoraggio del trattamento della malattia. Mentre un valore di soglia di oltre 2 μg/ml è stato dimostrato da molti ricercatori che monitorano il trattamento dei pazienti, ai laboratori si consiglia ancora di stabilire il proprio standard in modo che possa essere presa in considerazione la variazione demografica.
Soluzione per il monitoraggio del D-dimero Mindray
Gli analizzatori automatici della coagulazione C3100 e C3510 di Mindray sono dotati dei classici meccanismi di rilevazione sia meccanici che ottici. La metodologia meccanica non è sensibile alle interferenze di campioni itterici, lipemici, chilo ed emolitici. Inoltre, l'algoritmo brevettato VRIM (VLin-Rate Integrative Method) è stato sviluppato anche per combinare il "metodo a due punti" a una bassa concentrazione di D-dimero con il "Metodo di valutazione" a un livello superiore [Figura 3]. Ciò ha consentito una gamma molto più ampia di linearità dei risultati del D-dimero rispetto ad altri modelli sul mercato [Figura 4].
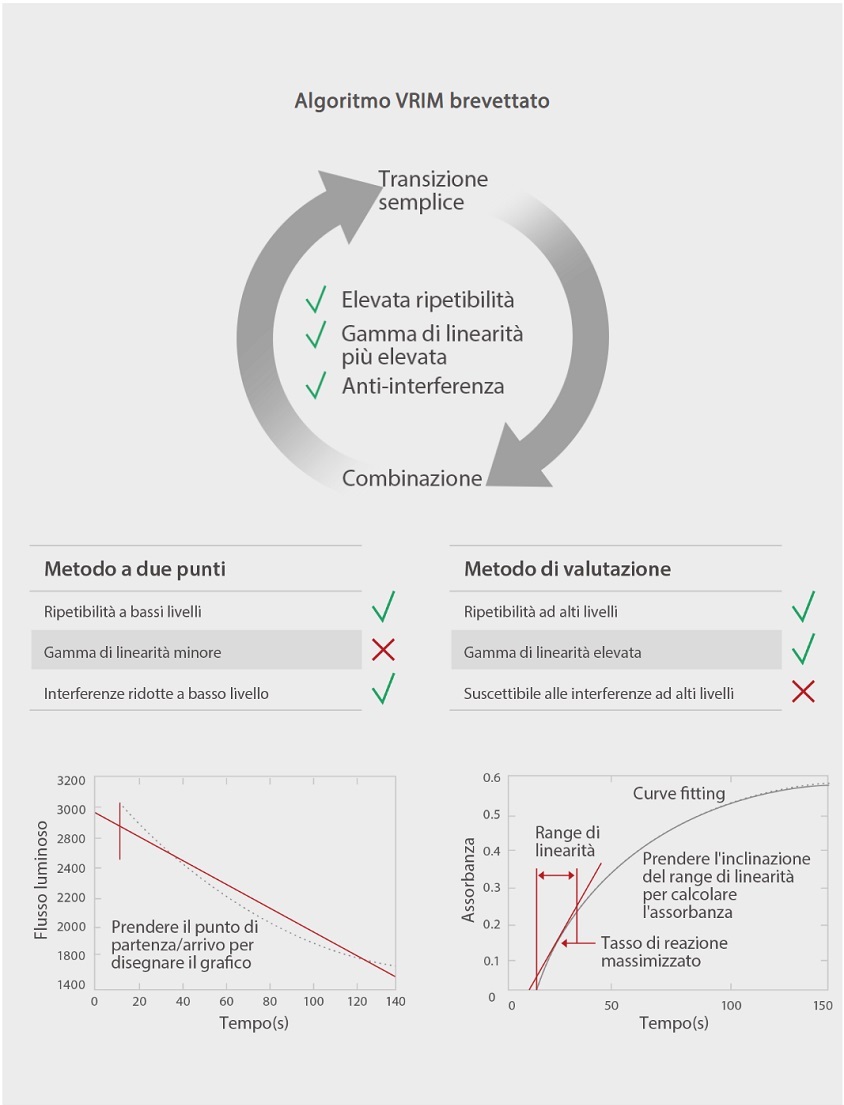
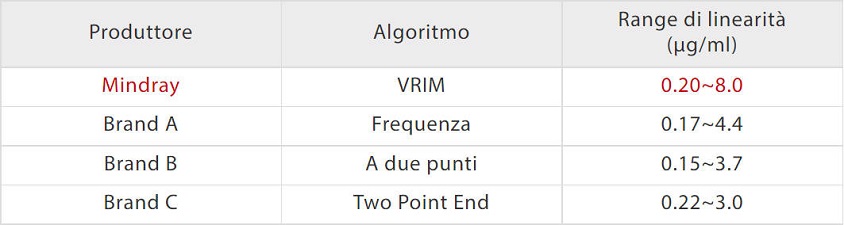
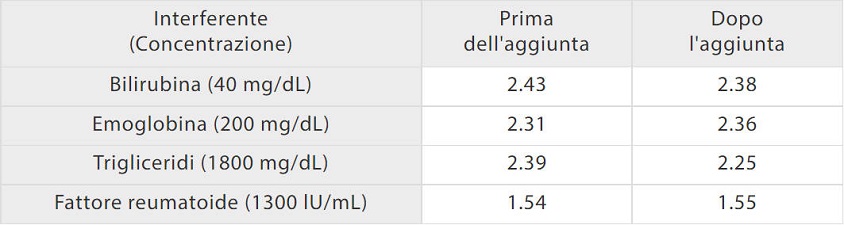
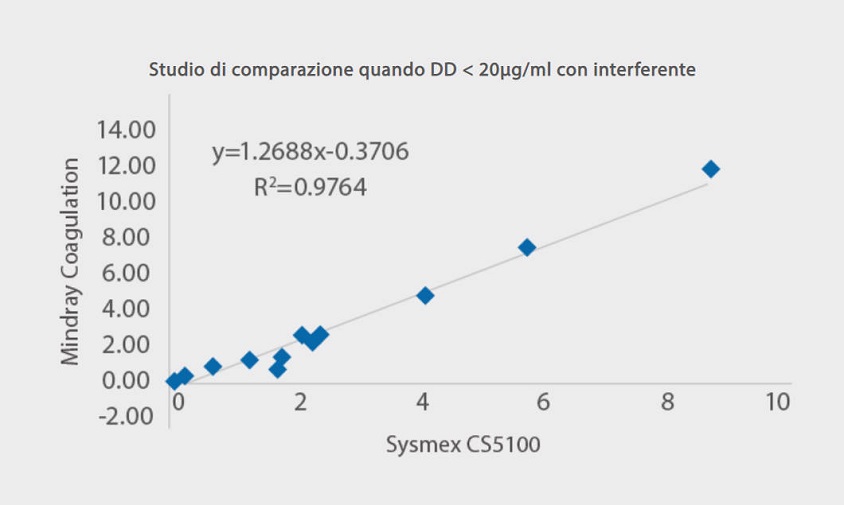
La soluzione di coagulazione di Mindray al test del D-dimero è meno sensibile ai comuni interferenti. Come mostrato nella [Figura 5], quando nei campioni di siero vengono aggiunti bilirubina, emoglobina, trigliceridi e fattori reumatoidi alla rispettiva concentrazione, i risultati del D-dimero rimangono a livelli costanti come prima. Lo studio di comparazione con Sysmex CS5100 ha mostrato una buona correlazione con R2> 97% con l'aggiunta di interferenti.
I reagenti di coagulazione D-dimero di Mindray sono tutti prodotti allo stato liquido in bottiglia e sono pronti all'uso [Figura 6], mentre la maggior parte dei kit di test di coagulazione sono in polvere. La preparazione può avvenire rapidamente e con facilità sugli analizzatori di coagulazione Mindray, è sufficiente aprire il tappo e caricare i reagenti D-dimero sull'analizzatore.
Riferimenti:
[1] Behl T., Kaur I., Bungau S., Kumar A., Uddin M. S., Kumar C., et al. (2020). The dual impact of ACE2 in COVID-19 and ironical actions in geriatrics and pediatrics with possible therapeutic solutions. Life Sci. 257, 118075. 10.1016/j.lfs.2020.118075.
[2] Tian S, Hu W, Niu L, Liu H, Xu H, Xiao SY. Pulmonary pathology of early phase 2019 novel coronavirus (COVID-19) pneumonia in two patients with lung cancer. J Thorac Oncol. 2020.
[3] Chousterman BG, Swirski FK, Weber GF. Cytokine storm and sepsis disease pathogenesis. Semin Immunopathol. 2017;39(5):517–28.
[4] Ding YQ, Bian XW. Analysis of coronavirus disease-19 (covid-19). Chin J Pathol. 2020;49(00):E003.
[5] Tang N., Li D., Wang X., Sun Z. (2020. b). Abnormal coagulation parameters are associated with poor prognosis in patients with novel coronavirus pneumonia. J. Thromb. Haemost. 18, 844–847. 10.1111/jth.14768
[6] Dawei Wang, Bo Hu ,et al. Clinical Characteristics of 138 hospitalized patients with 2019 novel Coronavirus-Infected Pneumonia in Wuhan,China[J]. JAMA. 2020.
[7] Fei Zhou., MD,a., Ting Yu., MD,b. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study. Lancet. 2020 28 March-3 April; 395(10229): 1054–1062.
[8] Shah Siddharth., Shah Kuldeep., Patel Siddharth B., Patel Foram S., Osman Mohammed., Velagapudi Poonam., Turagam Mohit K., Lakkireddy Dhanunjaya., Garg Jalaj.(2020). Elevated D-Dimer Levels Are Associated With Increased Risk of Mortality in Coronavirus Disease 2019: A Systematic Review and Meta-Analysis. Cardiol Rev, 28(6), 295-302. doi:10.1097/CRD.0000000000000330
[9] Zhang Y, Xiao M, Zhang S, et al. Coagulopathy and antiphospholipid antibodies in patients with Covid-19. N Engl J Med. 2020;382:e38.
[10] Simadibrata Daniel Martin., Lubis Anna Mira.(2020). D-dimer levels on admission and all-cause mortality risk in COVID-19 patients: a meta-analysis. Epidemiol Infect, 148(undefined), e202. doi:10.1017/S0950268820002022







