HemaBook, rozdział 7: Jaka jest zależność pomiędzy D-dimerami, a COVID-19 w procesie krzepnięcia?
Mindray 2020-12-31

D-dimery a COVID-19
W związku z ciągłym rozprzestrzenianiem się choroby COVID-19 na całym świecie szybkie stawianie diagnozy, jak również ocena rokowań i leczenie pacjentów zarażonych koronawirusem stały się ważnymi tematami w środowisku lekarskim. Ostatnio naukowcy odkryli, że COVID-19 posiada receptor komórek żywiciela, enzym zwany konwertazą angiotensyny typu II[1] (ACE-2). Enzym ACE2 ułatwia wnikanie wirusa powodującego chorobę COVID-19 do organizmu człowieka. Jego komórki gwałtownie rozmnażają się, niszcząc normalne komórki, tkanki i układ kapilarny, a w końcu powodując poważne uszkodzenie płuc, niewydolność wielonarządową[2-4]i krzepnięcie wewnątrznaczyniowe, które występuje u 71,4% chorych, którzy zmarli na COVID-19[5]. Powszechnie wiadomo, że D-dimery są ważnym biomarkerem powiązanym z nadkrzepliwością. Kolejne badania kliniczne wskazują również na związek pomiędzy D-dimerami, a chorobą COVID-19.
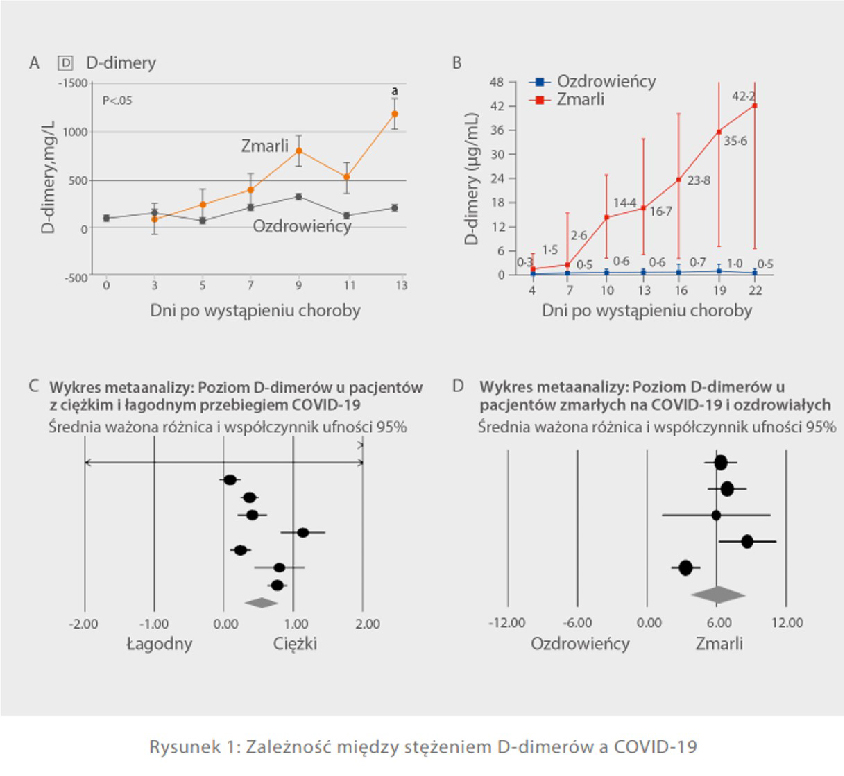
Zgodnie z publikacją zespołu dr Zhi Yonga na łamach tygodnika Amerykańskiego Towarzystwa Medycznego „Jama” w grupie chorych, którzy zmarli na nowe koronawirusowe zapalenie płuc, poziom D-dimerów początkowo wzrastał wraz z rozwojem choroby, aż do siódmego dnia, w którym poziom D-dimerów przekroczył normę, aby ostatecznie ustabilizować się na wysokim poziomie [Rys. 1 A][6]. Dla porównania poziom D-dimerów w grupie osób, które przeżyły, utrzymywał się w normalnym zakresie. W innym artykule opublikowanym w tygodniku „The Lancet” również pojawia się twierdzenie, że istnieje ścisła zależność pomiędzy poziomem D-dimerów a śmiertelnością chorych [Rys. 1 B][7]. Ten sam wniosek został wyciągnięty podczas badania grupy dr Shah, w którym do sporządzenia wykresów [Rys. 1 C, D][8]. wykorzystano metodę systematycznej metaanalizy (obejmującą wyniki z 18 artykułów i na próbie łącznie 3682 chorych). Podsumowując, poziom D-dimerów zarówno u ciężko chorych pacjentów, jak i osób zmarłych z powodu choroby COVID-19, był wyższy niż u ozdrowieńców lub osób, u których choroba miała łagodny przebieg.
Zastosowanie D-dimerów w prognozowaniu COVID-19
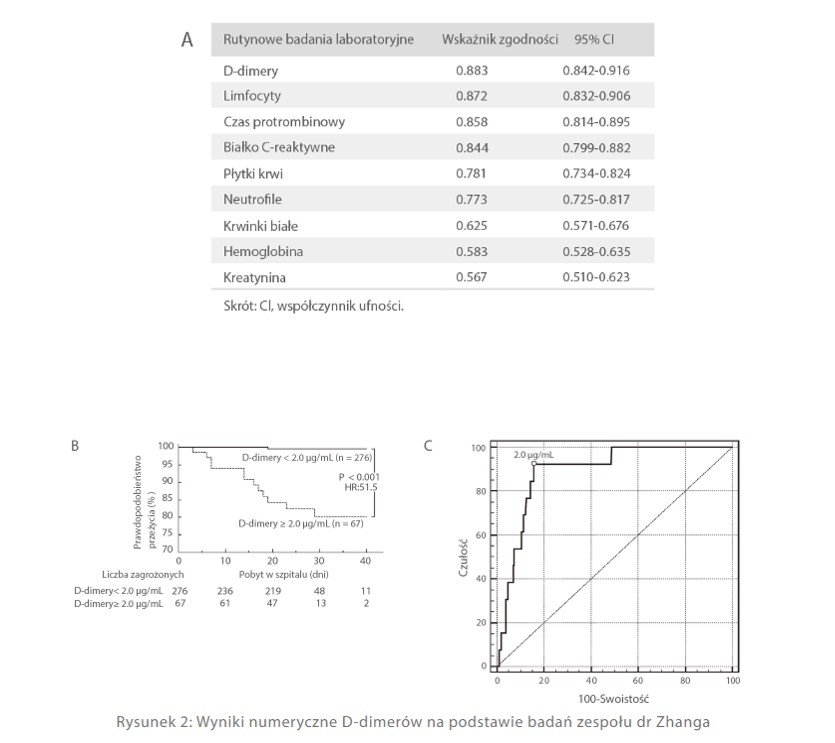
Według badań zespołu dr Zhanga D-dimery osiągają najwyższy wskaźnik zgodności spośród wszystkich parametrów badanych u pacjentów chorych na COVID-19, co wskazuje, że mają najwyższy współczynnik zbieżności prognostycznej w przypadku rutynowych metod badań laboratoryjnych [rys. 3 A]. Ponadto stwierdzili oni również, że ilość D-dimerów wynosząca 2 μg/ml może być wartością graniczną ryzyka śmierci na COVID-19, ponieważ przy DD > 2 μg/ml prawdopodobieństwo przeżycia drastycznie się zmniejsza [Rys. 2 B]. W związku z tym oparli wyliczenie na tej wartości i wykazali, że przy ustawieniu 2 μg/ml jako wartości granicznej, 92,3% czułości i 83,3% swoistości to wartości optymalne we wszystkich grupach [Rys. 2 C][9].
Istnieją dowody dotyczące zwiększonej częstotliwości występowania żylnej choroby zakrzepowo-zatorowej (ŻChZZ), w tym zakrzepicy żył głębokich (ang. DVT) i zatorowości płucnej (ang. PE), u chorych z ciężkim przebiegiem choroby COVID-19[9],a D-dimery mogą być także stosowane jako wskaźnik VTE i PE z wartością graniczną 0,55 μg/ml. Ponadto dr Yao nie tylko stwierdził, że pacjenci ze stężeniem D-dimerów powyżej 2 μg/mlpotrzebują intensywnej terapii i wczesnej interwencji, ale zasugerował, że wartość graniczna wynosząca 1 μg/ml może pomóc lekarzom w identyfikacji pacjentów o złych rokowaniach[10].
Podsumowując, D-dimery mają ogromną wartość kliniczną w leczeniu i prognozowaniu COVID-19 jako czuły wskaźnik monitorowania. Ze względu na zaburzenia mikrośrodowiska krzepnięcia u pacjentów chorych na COVID-19, osób zagrożonych wystąpieniem ŻChZZ z powodu zmniejszonej aktywności i wydłużonego czasu leżenia w łóżku lub u osób poddawanych kwarantannie w celu hospitalizacji konieczne jest regularne badanie stężenia D-dimerów w celu sprawnego monitorowania leczenia choroby. Podczas gdy wartość graniczna wynosząca ponad 2 ug/ml została poddana analizie przez wielu badaczy monitorujących leczenie pacjentów, zgodnie z zaleceniami laboratoria powinny nadal wyznaczać własne standardy, aby można było uwzględnić zróżnicowanie demograficzne.
Roztwór koagulacyjny Mindray do testowania D-dimerów
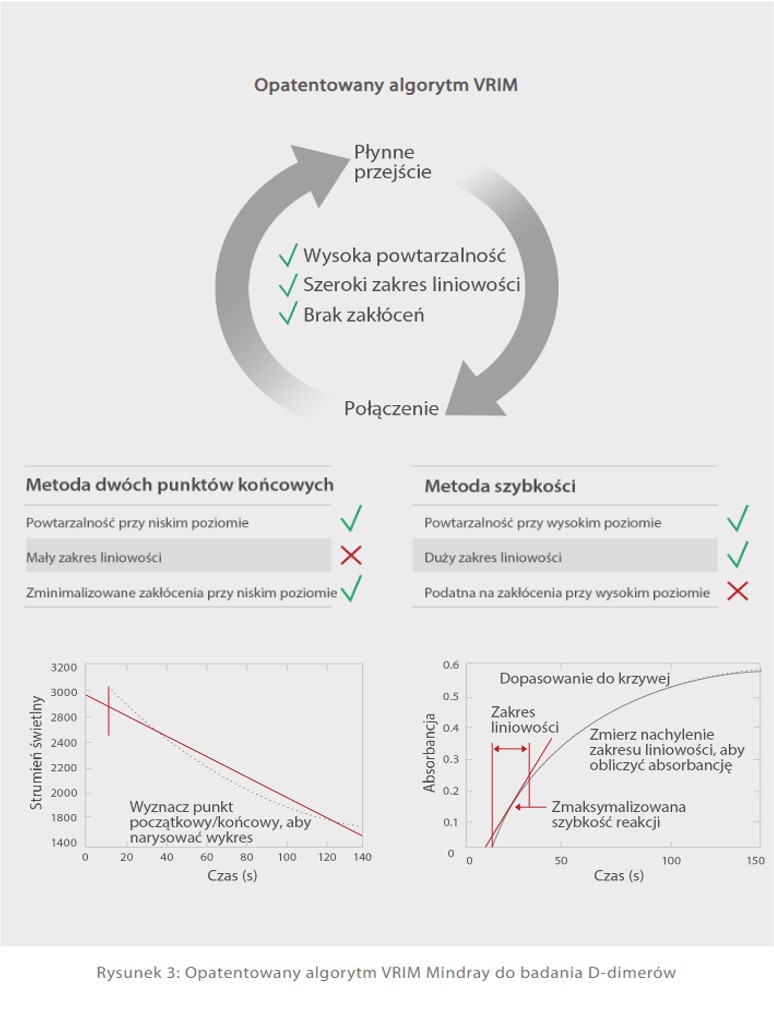
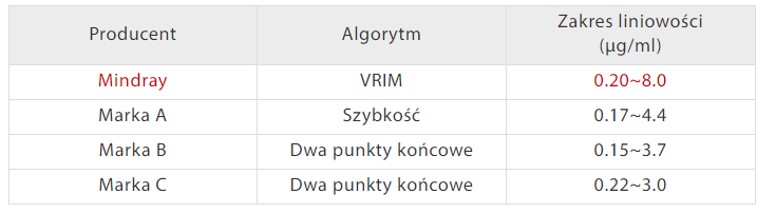
Analizatory autokoagulacji C3100 i C3510 Mindray są wyposażone zarówno w klasyczne mechanizmy wykrywania, jak i w mechanizmy optyczne. Metoda mechaniczna nie jest czuła na zakłócenia pochodzące z próbek żółtaczkowych, lipemicznych, chylusowych i hemolitycznych. Ponadto opatentowany algorytm VRIM (VLin-Rate Integrative Method) został również opracowany w celu połączenia metody dwóch punktów końcowych przy niskim stężeniu D-dimerów z metodą szybkości przy wyższym poziomie [Rys. 3]. Pozwoliło to na uzyskanie znacznie szerszego zakresu liniowości wyników D-dimerów w porównaniu z innymi modelami dostępnymi na rynku [Rys. 4].
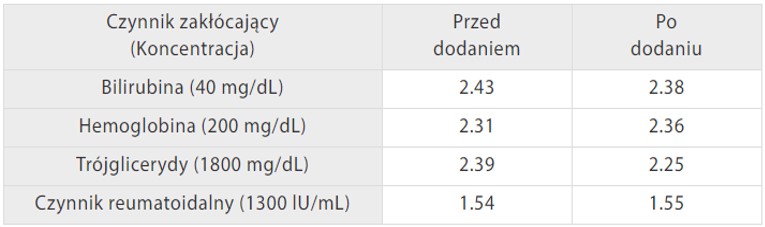
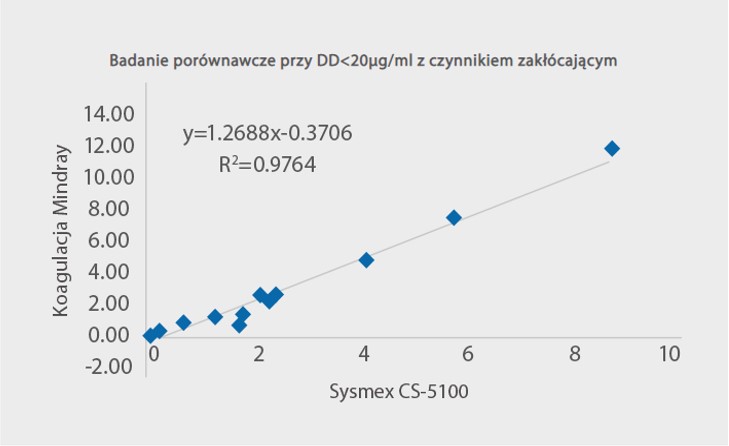
Ponadto roztwór koagulacyjny Mindray do testowania D-dimerów jest mniej podatny na typowe czynniki zakłócające. Jak pokazano na Rys. 5, gdy próbki surowicy są dodawane z bilirubiną, hemoglobiną, trójglicerydami i czynnikami reumatoidalnymi w odpowiednim stężeniu, wyniki D-dimerów pozostają na stałym poziomie jak poprzednio. Badanie porównawcze za pomocą urządzenia Sysmex CS-5100 wykazało również dobrą zależność przy R2> 97% z dodanymi czynnikami zakłócającymi.
Odczynniki do koagulacji D-dimerów Mindray są produkowane w formie butelkowanej cieczy, która jest gotowa do użycia [Rys. 6], podczas gdy większość zestawów do badania koagulacji zawiera odczynniki w postaci proszku. Preparat do stosowania w analizatorach koagulacji Mindray można przygotować szybko i łatwo. Wystarczy odkręcić zakrętkę i przelać odczynniki do oznaczania D-dimerów do urządzenia.
Bibliografia:
[1] Behl T., Kaur I., Bungau S., Kumar A., Uddin M. S., Kumar C., et al. (2020). The dual impact of ACE2 in COVID-19 and ironical actions in geriatrics and pediatrics with possible therapeutic solutions. Life Sci. 257, 118075. 10.1016/j.lfs.2020.118075.
[2] Tian S, Hu W, Niu L, Liu H, Xu H, Xiao SY. Pulmonary pathology of early phase 2019 novel coronavirus (COVID-19) pneumonia in two patients with lung cancer. J Thorac Oncol. 2020.
[3] Chousterman BG, Swirski FK, Weber GF. Cytokine storm and sepsis disease pathogenesis. Semin Immunopathol. 2017;39(5):517–28.
[4] Ding YQ, Bian XW. Analysis of coronavirus disease-19 (covid-19). Chin J Pathol. 2020;49(00):E003.
[5] Tang N., Li D., Wang X., Sun Z. (2020. b). Abnormal coagulation parameters are associated with poor prognosis in patients with novel coronavirus pneumonia. J. Thromb. Haemost. 18, 844–847. 10.1111/jth.14768
[6] Dawei Wang, Bo Hu, et al. Clinical Characteristics of 138 hospitalized patients with 2019 novel Coronavirus-Infected Pneumonia in Wuhan, China[J]. JAMA. 2020.
[7] Fei Zhou., MD,a., Ting Yu., MD,b. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study. Lancet. 28 marca - 3 kwietnia 2020; 395(10229): 1054–1062.
[8] Shah Siddharth., Shah Kuldeep., Patel Siddharth B., Patel Foram S., Osman Mohammed., Velagapudi Poonam., Turagam Mohit K., Lakkireddy Dhanunjaya., Garg Jalaj.(2020). Elevated D-Dimer Levels Are Associated With Increased Risk of Mortality in Coronavirus Disease 2019: A Systematic Review and Meta-Analysis. Cardiol Rev, 28(6), 295-302. doi:10.1097/CRD.0000000000000330
[9] Zhang Y, Xiao M, Zhang S, et al. Coagulopathy and antiphospholipid antibodies in patients with Covid-19. N Engl J Med. 2020;382:e38.
[10] Simadibrata Daniel Martin., Lubis Anna Mira.(2020). D-dimer levels on admission and all-cause mortality risk in COVID-19 patients: a meta-analysis. Epidemiol Infect, 148(undefined), e202. doi:10.1017/S0950268820002022










