Signification clinique de l'analyse lipidique dans la gestion de l'insuffisance rénale chronique (IRC)
Mindray 2021-06-09

Il est largement admis que l'étude en laboratoire du métabolisme des lipides est cliniquement importante pour l'estimation du risque de maladie coronarienne athérosclérosante (MCAS) et l'orientation de la prise de décision thérapeutique. Comme le recommandent les directives ESC/EAS sur la gestion des dyslipidémies 2019, l'analyse des lipides plasmatiques (par exemple TG, TC, HDL-C, LDL-C, apo B, Lp(a), etc.) et un traitement adapté sont des moyens appropriés de réduire le risque de MCAS[1]

L'insuffisance rénale chronique (IRC) est l'un des principaux problèmes de santé dans le monde. La prévalence de l'IRC est estimée à 13,4 % (11,7 %-15,1 %), dont 4,9 à 7,1 millions de patients dans le monde souffrant d'une insuffisance rénale terminale nécessitant une thérapie de remplacement rénal[2]
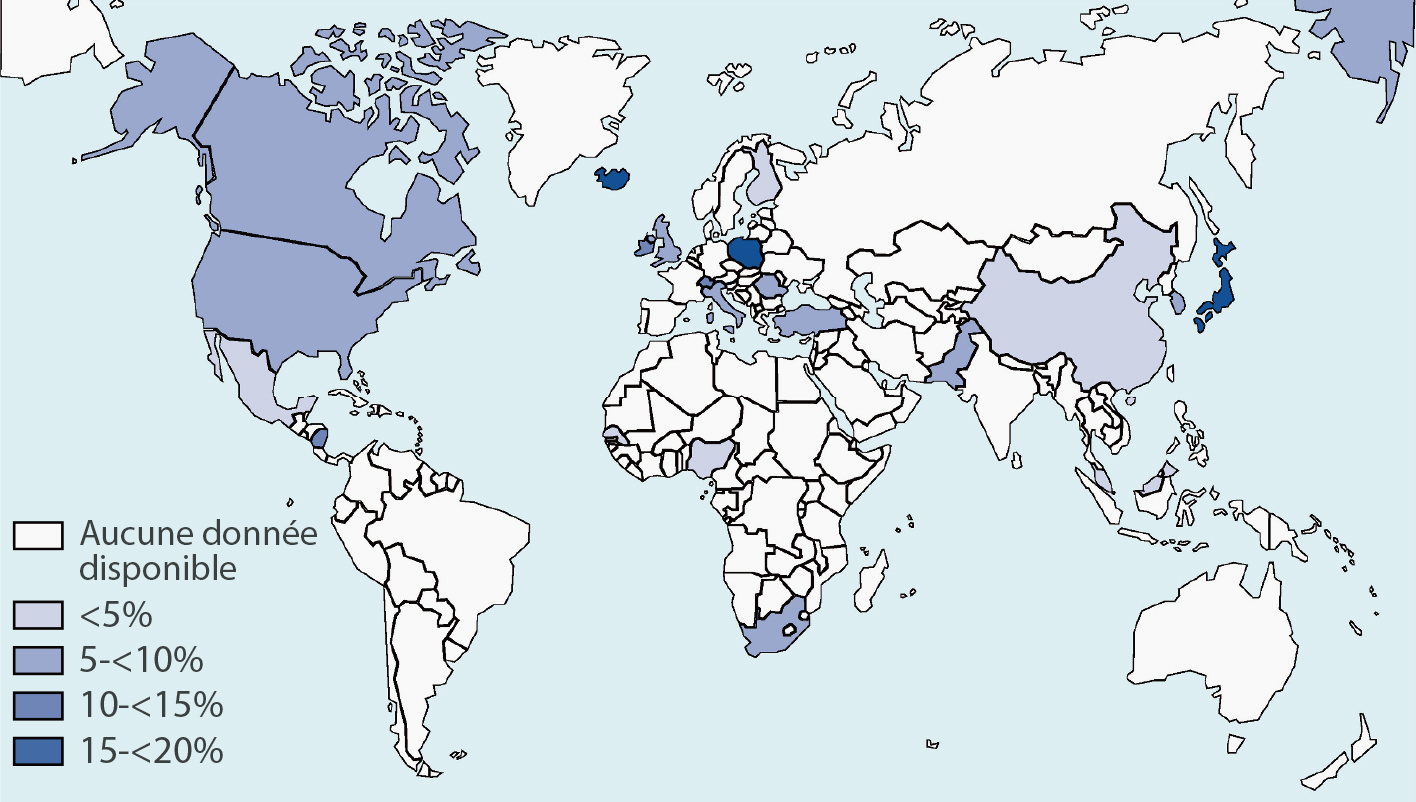
Dans la plupart des cas, les patients atteints d'IRC sont exposés à un risque d'accélération des maladies cardiovasculaires et de décès, et bon nombre des comorbidités cardiovasculaires pourraient être liées à la dyslipidémie, même s'il existe des différences significatives en termes de population, d'étiologies des lésions rénales, de stades de progression de la maladie et d'interventions thérapeutiques. Le niveau, la composition et la qualité des lipides plasmatiques pourraient être affectés par l'altération de la fonction rénale. Le profil lipidique caractéristique des patients atteints d'IRC au stade 3 ou plus consiste en une hypertriglycéridémie, de faibles niveaux de cholestérol HDL, de faibles niveaux d'Apo A1 et des niveaux variables de cholestérol LDL et de cholestérol total. Les niveaux de Lp(a) pourraient également augmenter en association avec l'IRC.[1,4]
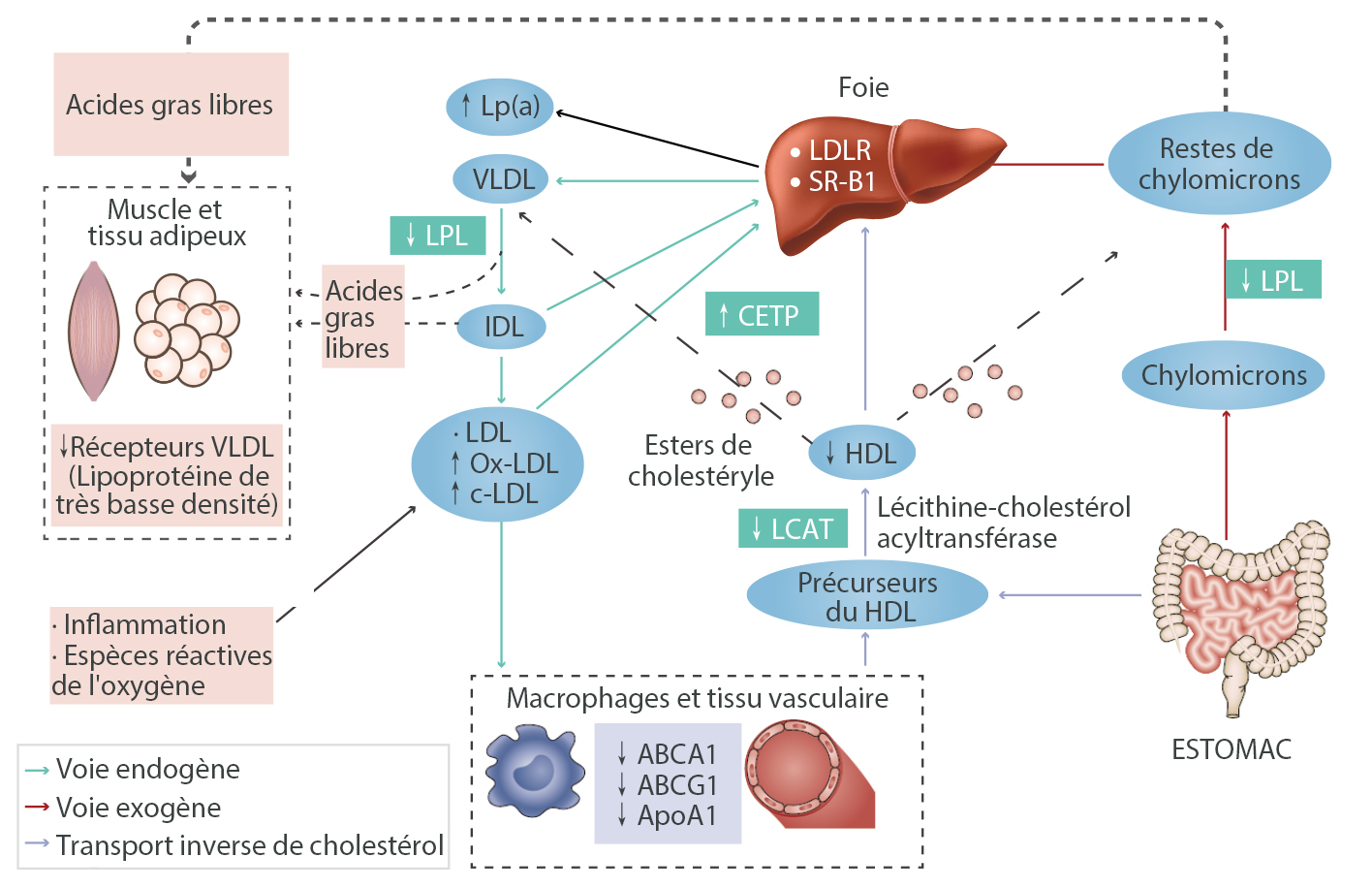
L'hypertriglycéridémie dans l'IRC résulte d'un catabolisme retardé des lipoprotéines riches en triglycérides. La synthèse de l'Apo A1 est réduite chez les patients atteints d'IRC, et l'activation de la LCAT par l'Apo A1 est également diminuée. Par conséquent, la maturation des précurseurs du HDL est également affectée. L'augmentation des Lp(a) est due à la modification post-traductionnelle des lipoprotéines liées à l'IRC.
Par conséquent, en raison de la relation entre l'IRC et la dyslipidémie, il est recommandé de procéder à un bilan lipidique pour aider à la prise en charge de la maladie chez de nombreux patients.
L'insuffisance rénale : L'organisation Improving Global Outcomes (KDIGO) a publié ses dernières directives en 2013. Comme le recommandent les directives de pratique clinique, tous les adultes atteints d'une IRC récemment identifiée (y compris ceux traités par dialyse chronique ou transplantation rénale) doivent être soumis à un bilan lipidique (TG, TC, LDL-C et HDL-C). Il est recommandé de procéder à un examen du profil lipidique à jeun, en particulier pour les patients présentant des anomalies lipidiques significatives connues. De plus, chez certains patients atteints d'IRC âgés de moins de 50 ans, le bilan lipidique pourrait confirmer le besoin d'un traitement par statine et aider à identifier toute cause secondaire sous-jacente d'hypercholestérolémie et/ou d'hypertriglycéridémie sévère[5]
Chez les patients ayant subi une transplantation rénale, les dyslipidémies pourraient être très fréquentes, ce qui les exposerait à un risque élevé de MCAS et de vasculopathies artérielle de transplantation. Il est recommandé d'évaluer le risque de développer une maladie cardiovasculaire chez ces patients, et une analyse complète des lipides est utile.Si le profil lipidique fait état de valeurs se rapprochant de la fourchette normale, et ce de manière soutenue, le risque de MCAS pourrait être considérablement réduit.[6,7]
À l'inverse, contrairement à la surveillance du cholestérol LDL impliquée dans la gestion thérapeutique de la plupart des patients, la surveillance du taux lipidique n'est pas prise en compte par le groupe de travail KDIGO (2013) chez les patients IRC dont le DFG est diminué, en absence de faits probants directs. Comme un faible DFG est un facteur de risque indépendant de MCAS, un traitement hypolipidémiant strict ne modifierait pas la prise en charge médicale et ne réduirait pas le risque d'événements cardiovasculaires majeurs.[5]
Cependant, certains essais ont révélé que l'abaissement du taux de cholestérol LDL est bénéfique, car il réduit le risque cardiovasculaire des patients IRC ne nécessitant pas de dialyse (y compris les transplantés rénaux), tandis que d'autres directives suggèrent un suivi des lipides pour s'assurer que l'objectif de réduction du cholestérol est atteint.[4]Par conséquent, l'analyse lipidique a un grand potentiel dans la prise en charge des patients atteints d'IRC, notamment à des fins d'évaluation du suivi du traitement par statine, de l'évolution de la modalité de traitement de remplacement rénal ou des préoccupations concernant la présence d'une nouvelle cause secondaire de dyslipidémie, voire pour évaluer le risque cardiovasculaire à 10 ans chez les patients âgés de moins de 50 ans et ne recevant pas actuellement de statine.[5]
Pour résumer, le bilan lipidique joue un rôle essentiel dans la réduction des risques de MCAS, bien qu'il puisse s'avérer compliqué chez les patients atteints d'IRC, une condition médicale courante dans le monde entier. Tous les patients atteints d'une IRC nouvellement identifiée doivent être soumis à un bilan lipidique et nombre de ces patients pourraient bénéficier d'une intervention médicale basée sur la surveillance des lipides.
Références:
[1] François Mach, et al. 2019 ESC/EAS Guidelines for the management of dyslipidaemias: lipid modification to reduce cardiovascular risk. European Heart Journal, 2020(1)41, 111–188, https://doi.org/10.1093/eurheartj/ehz455
[2] Lv JC, Zhang LX. Prevalence and Disease Burden of Chronic Kidney Disease. Adv Exp Med Biol. 2019; 1165:3-15. doi: 10.1007/978-981-13-8871-2_1
[3] Webster, A., Nagler, E., Morton, R. et al. Chronic kidney disease.The Lancet. 2017; 389: 1238-1252. https://doi.org/10.1016/S0140-6736(16)32064-5
[4] Ferro, C.J., Mark, P.B., Kanbay, M. et al. Lipid management in patients with chronic kidney disease.Nat Rev Nephrol. 14, 727–749 (2018). https://doi.org/10.1038/s41581-018-0072-9
[5] Wanner C, Tonelli M, et al. KDIGO Clinical Practice Guideline for Lipid Management in CKD: summary of recommendation statements and clinical approach to the patient. Kidney Int. 2014 Jun;85(6):1303-9. doi: 10.1038/ki.2014.31
[6] JJennifer L Larsen, et al. Lipid Status After Pancreas-Kidney Transplantation. Diabetes Care Jan. 1992, 15 (1) 35-42; DOI: 10.2337/diacare.15.1.35
[7] Claudio Ponticelli, et al. Treatment of dyslipidemia in kidney transplantation. Expert Opinion on Drug Safety. (2020) 19 :3, 257-267, DOI: 10.1080/14740338.2020.1732921









