HemaBook Capítulo 9: ¿Cómo cambia el recuento de eosinófilos en los pacientes de COVID-19?
Mindray 2021-05-09

¿Es la terapia anticoagulante profiláctica un tratamiento común para tratar los eventos trombóticos en el COVID-19?
¿Existe una relación entre el recuento de eosinófilos y el control de la anticoagulación en los pacientes de COVID-19?
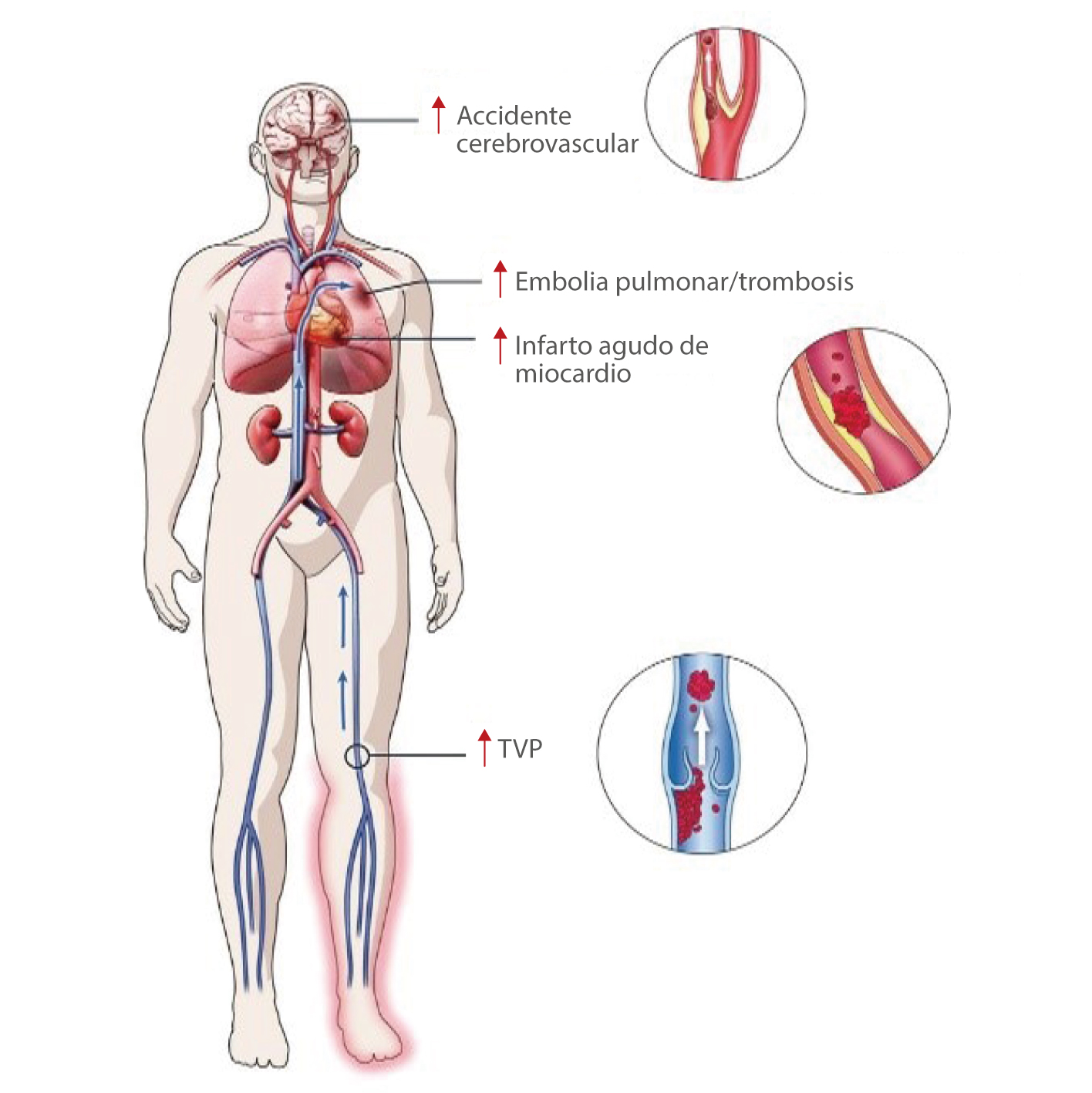
Eventos trombóticos en pacientes de COVID-19
La trombosis ha surgido como una complicación importante entre los pacientes hospitalizados con COVID-19. Un estado protrombótico inducido por el virus SARS-Cov-2 puede manifestarse en tromboembolismo venoso (TEV), trombosis arterial y coagulación intravascular diseminada (CID).[1]
En 28 estudios que incluyeron a 2928 pacientes, se produjeron complicaciones trombóticas en el 34 % de los pacientes de la UCI, se registró trombosis venosa profunda (TVP) en el 16,1 % y embolia pulmonar en el 12,6 % de los pacientes, y se asociaron a una mortalidad elevada.[2]
Tratamiento antitrombótico con heparinas de bajo peso molecular en pacientes con COVID-19
La Sociedad Internacional de Trombosis y Hemostasia (ISTH) y la Sociedad Americana de Hematología (ASH) recomiendan la heparina de bajo peso molecular (HBPM) y la heparina no fraccionada (HNF) para el tratamiento de los episodios trombóticos asociados a la infección por SARS-CoV-2. En particular, la HBPM tiene un mayor efecto antitrombótico que la HNF.
Control de la dosis de HBPM
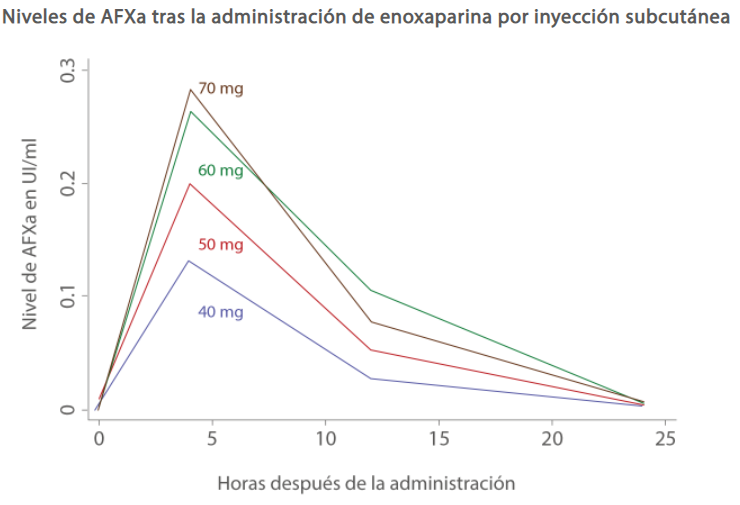
La HBPM actúa predominantemente sobre el factor Xa. Por esta razón, la actividad de la HBPM se supervisa utilizando los niveles de actividad del antifactor Xa en suero (AFXa) en lugar del tiempo de tromboplastina parcial activado (TTPa) (Figura 2).[3]

La enoxaparina es una de las HBPM más importantes. El nivel de AFXa alcanzó el máximo 3 a 5 horas después de la administración. Los niveles de AFXa por debajo de 0,2 UI/ml pueden aumentar el riesgo de TEV en pacientes con COVID-19, debido a la hipercoagulabilidad.[4]
Recuento de eosinófilos en el tratamiento antitrombótico para pacientes de COVID-19
La Dra. Selma Ari ha comprobado que el aumento del recuento de eosinófilos está asociado con el nivel de anticoagulación subprofiláctica en los pacientes de COVID-19.[5]
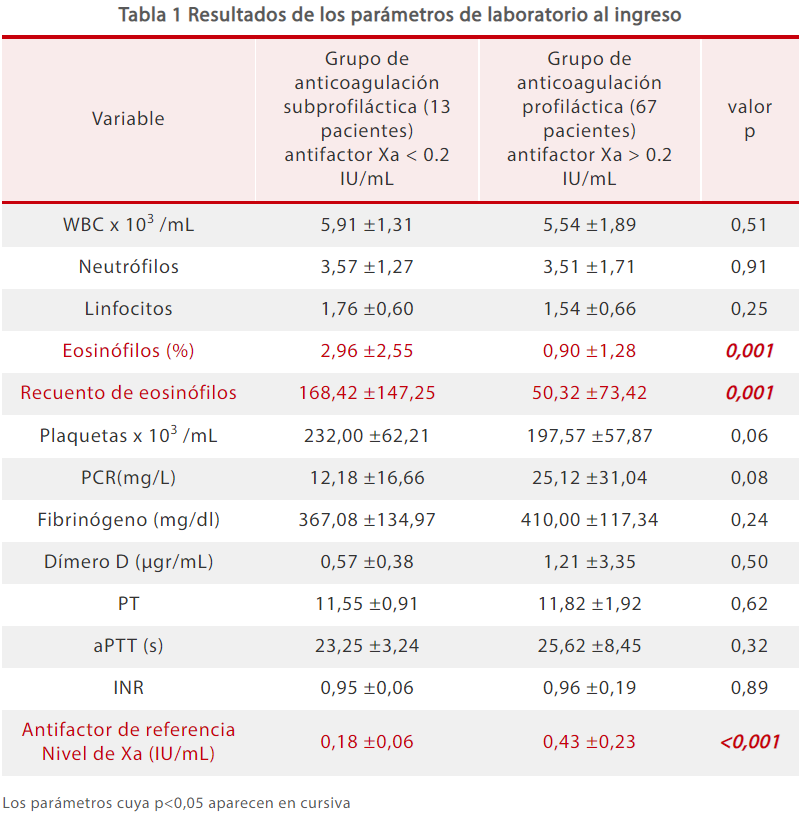
En los resultados de laboratorio, sólo los recuentos de eosinófilos y el AFXa son significativamente diferentes entre el grupo de anticoagulación subprofiláctica y el grupo de anticoagulación profiláctica cuando los pacientes ingresan en el hospital (Tabla 1).[5]
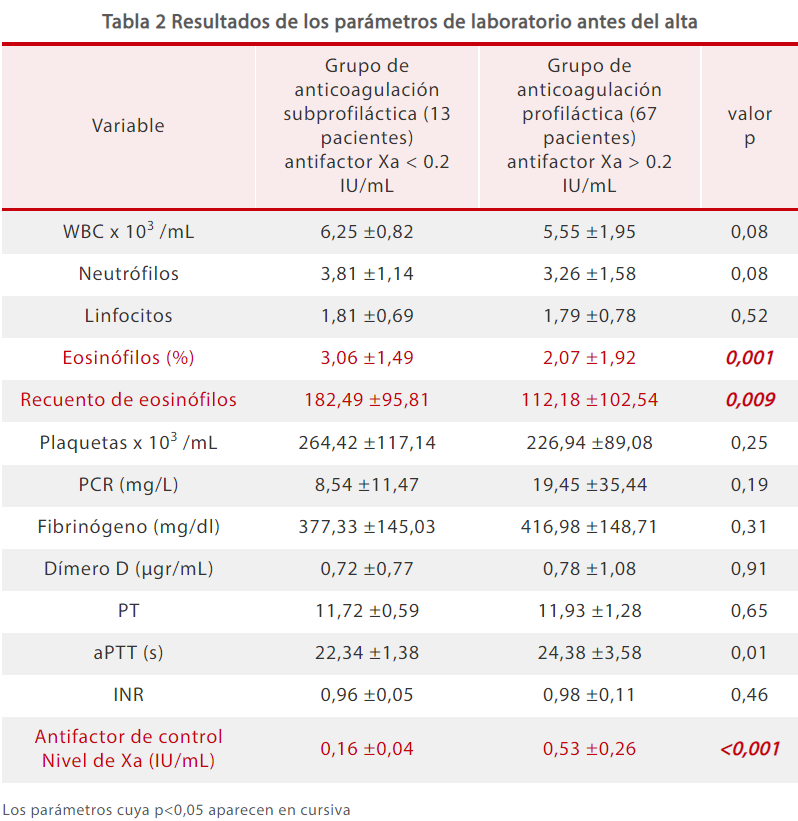
Los análisis de laboratorio recogidos antes del alta de los pacientes revelaron que los recuentos de eosinófilos en el grupo de anticoagulación subprofiláctica fueron mayores que en el grupo de anticoagulación profiláctica, mientras que los AFXa fueron menores en el grupo de anticoagulación subprofiláctica (Tabla 2).[5]
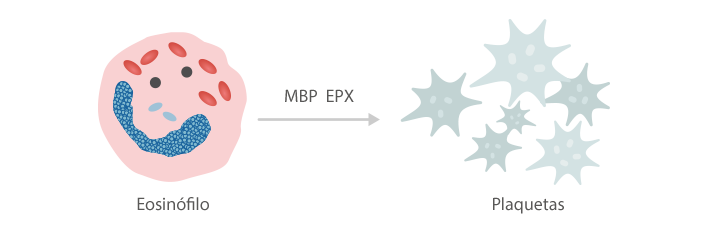
Eosinófilos y trombosis
El eosinófilo induce la agregación plaquetaria y la formación de trombos mediante la producción de la proteína básica mayor (MBP) y la peroxidasa del eosinófilo (EPX).[6]
Las enzimas liberadas por los eosinófilos (peroxidasas, proteínas catiónicas y neurotoxinas) pueden disminuir la actividad anticoagulante de la heparina.[7]
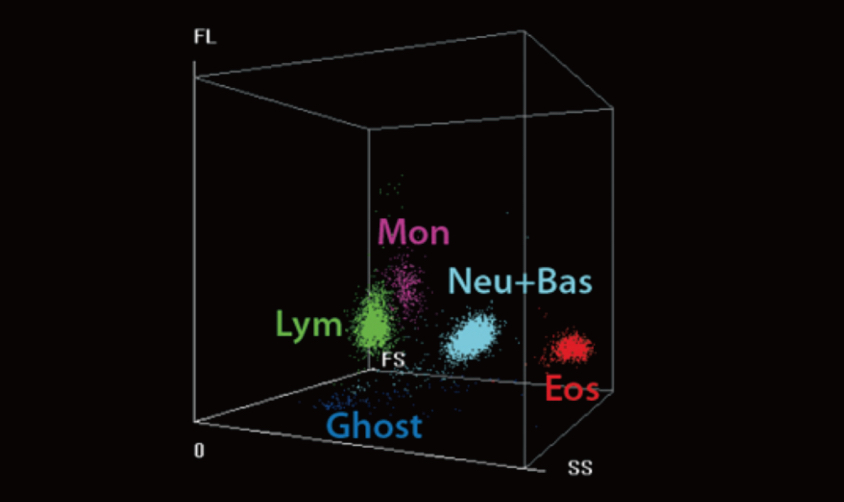
En este estudio, en el grupo de anticoagulación subprofiláctica, los niveles altos de eosinófilos tuvieron una menor actividad anticoagulante en los pacientes de COVID-19. Los recuentos de eosinófilos se examinaron con el analizador hematológico automático Mindray BC-6800. Su tecnología de análisis SF Cube puede producir un diagrama de dispersión tridimensional que puede ayudar a los médicos a identificar y diferenciar mejor las poblaciones de células sanguíneas, especialmente para revelar poblaciones de células anormales no detectadas por otras técnicas. Hoy en día, un gran número de parámetros en el BC-6800 pueden utilizarse en el diagnóstico clínico y la investigación científica. Por lo tanto, se motiva al personal clínico a realizar más investigaciones sobre COVID-19 con el BC-6200/BC-6800/BC-6800Plus/CAL 6000/CAL 8000 de Mindray.
Referencias:
[1] Godoy, L. C., Goligher, E. C., Lawler, P. R., Slutsky, A. S. & Zarychanski, R. Anticipating and managing coagulopathy and thrombotic manifestations of severe COVID-19. CMAJ 192, E1156-E1161, doi:10.1503/cmaj.201240 (2020).
[2] Jenner, W. J. et al. Thrombotic complications in 2928 patients with COVID-19 treated in intensive care: a systematic review. J Thromb Thrombolysis, doi:10.1007/s11239-021-02394-7 (2021).
[3] Lai, S. & Coppola, B. Use of enoxaparin in end-stage renal disease. Kidney Int 84, 433-436, doi:10.1038/ki.2013.163 (2013).
[4] Robinson, S. et al. Enoxaparin, effective dosage for intensive care patients: double-blinded, randomised clinical trial. Crit Care 14, R41, doi:10.1186/cc8924 (2010).
[5] Ari, S. et al. Elevated eosinophil count is related with lower anti-factor Xa activity in COVID-19 patients. J Hematop, 1-10, doi:10.1007/s12308-020-00419-3 (2020).
[6] Varricchi, G. et al. Reslizumab and Eosinophilic Asthma: One Step Closer to Precision Medicine? Front Immunol 8, 242, doi:10.3389/fimmu.2017.00242 (2017).
[7] Ames, P. R., Aloj, G. & Gentile, F. Eosinophilia and thrombosis in parasitic diseases: an overview. Clin Appl Thromb Hemost 17, 33-38, doi:10.1177/1076029609348314 (2011).